先日、電離について勉強した時に各々の言葉について理解が出来ていなかったことに気付き、「溶ける」と言うことと関連知識について改めてまとめてみました。
まずは溶液から行きましょう。
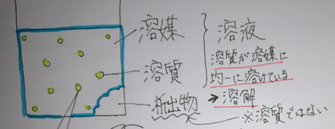
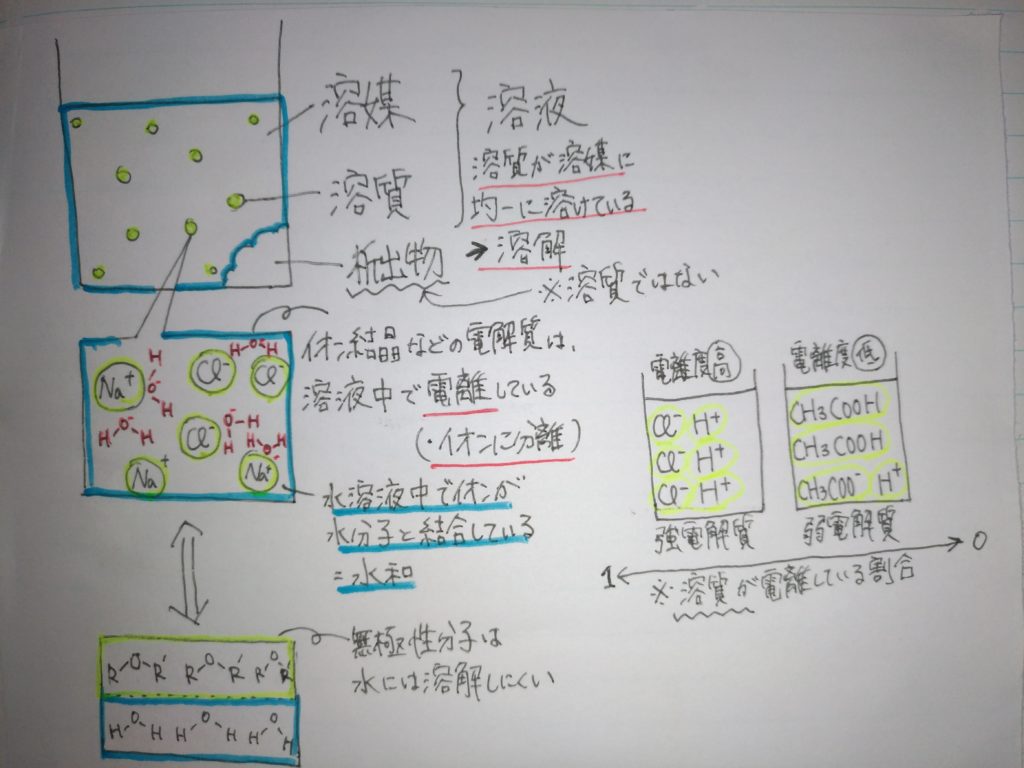
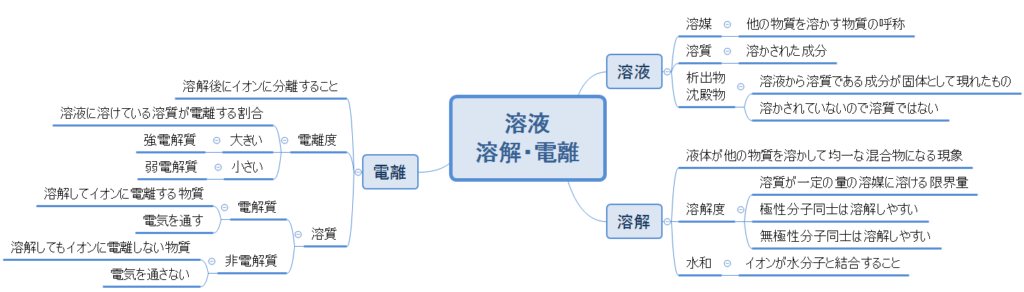
●溶液
溶液を構成する物質は大きく分けて2つありました。
・溶媒:溶かす物質
・溶質:溶かされている物質
ですね。
溶かされずに堆積した物質は溶けていないので、溶質とはよびません。
それは、沈殿物、析出物です。
————————————————————————-
●溶けるとは?
溶けるというのはどういった状態でしょうか。
・溶ける:ある物質の分子が液体中に均一に拡散する。溶解する。
・溶解:液体が他の物質を溶かして均一な混合物になる現象、
という定義がありました。
塩化ナトリウムの例で説明してみたいと思います。
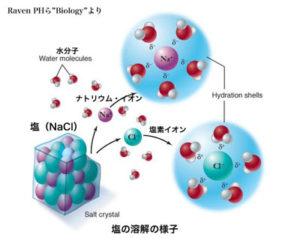
図はこちらの方のブログより
図を見ると、塩化ナトリウムは、水中でイオンに分かれています。それだけではなく、溶媒である水の水分子とそれぞれのイオンが結合していますね。これは溶解している状態と言えます。
但し、図のようにイオンに分かれている必要はなく、
溶質分子が溶媒の分子と結合して均一に分散していれば、それは溶解と呼ぶことが出来ます。
「溶質分子が溶媒の分子と結合して」と言うのと「均一に」がキーです。
均一ではなく、溶質の量が多すぎて溜まっているところがある状態であれば「溶解」とはいえなさそうです。
⇔溶解しないとは?
では、逆の溶けていない状態とはどのような状態でしょうか。
溶質が過剰な場合もあるかもしれませんが、
下図のような状態のことを溶解していないと言います。

イメージとしては水と油です。
このような状態になるのは、極性分子と無極性分子の組み合わせ、と言われています。
極性の高い低いについては、以前に説明したこちらの記事を参照ください。
例えば極性分子であるNaClが、溶媒中でイオンNa⁺とCl-になりたくても
溶媒側の物質にプラスやマイナスの部分がないとなると結合することが出来ない、ですよね。磁石が紙にくっつきたくてもくっつけないのと同じです。
そうすると互いに溶解できないので、極性分子と無極性分子は混ざり合わないのです。
●溶解にも種類があります
・電離:溶質が溶解後にイオンに分離すること
(電離のうち、水溶液中で電離したイオンが水分子と結合していることを水和といいます)
先ほど出てきた塩化ナトリウムがイオンに分離していた現象は、「電離」と言うことが出来ますし、電離したイオンが水分子と結合もしていたのは「水和」と言えます。
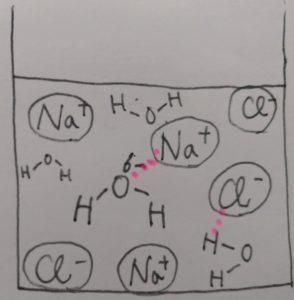
NaClが均一に溶けていれば、それは溶解しており、
その時NaClはイオンに分離するので電離しており
その時NaCl各イオンは水分子と結合しているので水和している、
と言うことです。
●電離しやすい物質と電離しにくい物質
NaClのように電離しやすい物質もあれば、あまり電離しないものもあります。
溶媒中で沢山電離する物質のことを電解質
→強電解質と弱電解質があります。
溶媒中で電離しない物質のことを非電解質
と呼ばれています。
以上の内容をまとめた図はこちらです。(いつも汚くてごめんなさい)
——————————————————————
さて、ここまでの説明だと、
沢山溶解するものは沢山電離するんじゃないか、と言う気がしてきますよね。
実は違うんですね。沢山溶解するけど電離はちょっとと言う物質があるんです。
またはその逆で電離度は大きいけどあまり溶解しない、と言う物質もあるんです。
●溶解度と電離度の関係性
まずは定義を確認しましょう。
・溶解度:ある溶質が一定の量の溶媒に溶ける限界量
・電離度:溶質が電離する割合
下表、あまりよい分け方ではないかもしれませんが分かる範囲内で分類してみました。
全てについて説明したいのですが、今日は2つのみに絞りたいと思います。
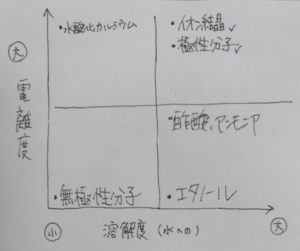
先ほどお伝えした
沢山溶解するけど電離はちょっとと言う物質は、エタノール
電離度は大きいけどあまり溶解しないと言う物質は、水酸化カルシウム
のことでした。
何故このようなことが起こるのでしょうか?
●エタノール C2H5-OH
エタノールは、親水基である-OH基と親油基である-C2H5の両方を持っているため、
その両方によく溶ける物質と言われています。では、何故電離が少ないのでしょうか?
電離とは、「溶質が溶解後にイオンに分かれること」でした。
どういう物質がイオンに分かれやすかったでしょうか?
名前からイメージがつきやすいのはイオン結晶ですね。
イオン結晶は、陽イオンと陰イオンの間の静電引力によって結合している結晶でしたが、そもそも何で陽イオンと陰イオンに分かれるのか、と言うところがキーです。
下図は電気陰性度を示した図ですが、こちらを参照すると、
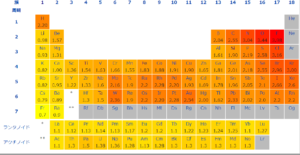
陽イオンになりやすい金属結合は、電気陰性度が低く
陰イオンになりやすい非金属結合は、電気陰性度が高め
であることが分かります。
つまり電気陰性度が高い側が電子を引っ張ろうとする力が強いため、陽イオンと陰イオンに分極、その静電引力で結合しているのです。
イオン結晶と同様、極性分子も電離度が高い、と言われますがそれも+とーに分極しているからであり、何故分極しているか、と言えば電気陰性度に差があるからです。
では何故エタノールは電離しないのか、と言う本題です。
電気陰性度と分極がキーです。
エタノールのヒドロキシ基の酸(O)は、電気陰性度の高い原子の代表です。
なのでエチル基C2H5の炭素原子Cとヒドロキシ基-OHの酸素原子Oの間にも電気陰性度の差は存在しています。
ですが電離するほど差がなく、電離するほどは分極していない、と言うのが結論です。
試しに電気陰性度の差を比べてみましょう。
【例】
*Na+とCl-の電気陰性度の差:
塩素(3.16) ―ナトリウム(0.93) =2.23
*C2H5のCと-OHのOの電気陰性度の差:
酸素(3.44)―炭素(2.55)=0.89
このように多少分極はしているけれども、その差が少しであるため、あまり溶媒中で電離しないのです。
同じ理由から、メタノール(CH3-OH)も電離しにくい物質です。
<まとめ>
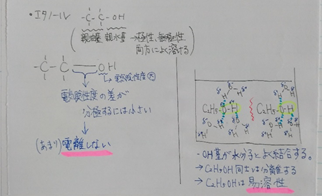
分かりましたでしょうか…?
続いて、水酸化カルシウムです。
●水酸化カルシウム Ca(OH)2
水酸化カルシウムはイオン結合分子ですね。なのでよく電離します。
電気陰性度も一応見てみると
Ca(電離度1)、O(電離度2.55)=その差は1.55
ただ水に溶けにくいんです。
水酸化カルシウムはその性質上、溶解する時に発熱します。
水酸化ナトリウムなど他の多くの物質は、溶解する時には吸熱を必要とするため、温度が高くなれば吸収できる熱も増えてさらに多く溶解できるようになります。
水酸化カルシウムはその逆であるため、温度が高くなると、逆にイオン結合するようになります。
水への溶解度は、単位と温度もあっていなくて申し訳ないのですが、以下の数値から大分差がありそうなことだけは分かるかと思います。
水酸化カルシウム0.17 g / 0.1L(25℃)
水酸化ナトリウムは、1110 g / L (20 °C)
<まとめ>
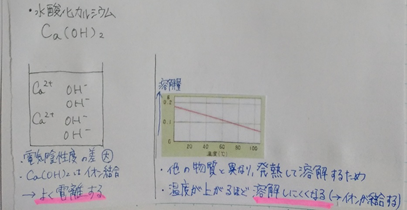
※でも-OH基があるのに何で溶けないんだよう!と言う疑問が消えませんよね。私もです。
―――――――――――――――――――――――
全体的にまとまりが悪いですが、少しでも何かイメージが掴めていれば幸いです…。
また更に勉強したことがあれば適宜追加・修正していきます。


コメントを残す